一、基本概念
1、化学变化:生成了其它物质的变化
2、物理变化:没有生成其它物质的变化
3、物理性质:不需要发生化学变化就表现出来的性质(如:颜色、状态、密度、气味、熔点、沸点、硬度、水溶性等)
4、化学性质:物质在化学变化中表现出来的性质(如:可燃性、助燃性、氧化性、还原性、酸碱性、稳定性等)
5、纯净物:由一种物质组成
6、混合物:由两种或两种以上纯净物组成,各物质都保持原来的性质
7、元素:具有相同核电荷数(即质子数)的一类原子的总称。元素的种类由质子数决定,元素的化学性质由最外层电子子数决定
8、原子:是在化学变化中的最小粒子,在化学变化中不可再分
9、分子:是保持物质化学性质的最小粒子,在化学变化中可以再分
10、单质:由同种元素组成的纯净物
11、化合物:由不同种元素组成的纯净物
12、氧化物:由两种元素组成的化合物中,其中有一种元素是氧元素
13、化学式:用元素符号来表示物质组成的式子
14、相对原子质量:以一种碳原子的质量的1/12作为标准,其它原子的质量跟它比较所得的值某原子的相对原子质量=相对原子质量≈质子数+中子数(因为原子的质量主要集中在原子核)
15、相对分子质量:化学式中各原子的相对原子质量的总和
16、离子:带有电荷的原子或原子团
17、原子的结构:原子、离子的关系:注:在离子里,核电荷数=质子数≠核外电子数
18、四种化学反应基本类型:
①化合反应:由两种或两种以上物质生成一种物质的反应,如:A+B=AB
②分解反应:由一种物质生成两种或两种以上其它物质的反应,如:AB=A+B
③置换反应:由一种单质和一种化合物起反应,生成另一种单质和另一种化合物的反应,如:A+BC=AC+B
④复分解反应:由两种化合物相互交换成分,生成另外两种化合物的反应如:AB+CD=AD+CB
复分解反应发生的条件
(1)有水生成H++OH-=H2O
(2)有气体生成CO32-+酸=CO2↑
(2)有沉淀生成:五白一蓝一褐7种沉淀
五白是AgCl、BaSO4、CaCO3、BaCO3、Mg(OH)2
一蓝是Cu(OH)2
一褐是Fe(OH)2
19、还原反应:在反应中,含氧化合物的氧被夺去的反应(不属于化学的基本反应类型)
氧化反应:物质跟氧发生的化学反应(不属于化学的基本反应类型)
缓慢氧化:进行得很慢的,甚至不容易察觉的氧化反应自燃:由缓慢氧化而引起的自发燃烧
20、催化剂:在化学变化里能改变其它物质的化学反应速率,而本身的质量和化学性在化学变化前后都没有变化的物质(注:2H2O2===2H2O+O2↑此反应MnO2是催化剂)
21、质量守恒定律:参加化学反应的各物质的质量总和,等于反应后生成物质的质量总和。(反应的前后,原子的数目、种类、质量都不变;元素的种类也不变)
22、溶液:一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物溶液的组成:溶剂和溶质。(溶质可以是固体、液体或气体;固、气溶于液体时,固、气是溶质,液体是溶剂;两种液体互相溶解时,量多的一种是溶剂,量少的是溶质;当溶液中有水存在时,不论水的量有多少,我们习惯上都把水当成溶剂,其它为溶质。)
23、固体溶解度:在一定温度下,某固态物质在100克溶剂里达到饱和状态时所溶解的质量,就叫做这种物质在这种溶剂里的溶解度。
溶解度曲线的意义:
1、溶解度曲线上的点表示该点对应温度时物质的溶解度。
2、两条曲线相交的点表示这两种物质溶解度在该温度时相等。
24、酸:由氢元素和酸根组成的化合物叫做酸。如:HCl==H++Cl- HNO3==H++NO3-
H2SO4==2H++SO42-
26、碱:由金属和氢氧根组成的化合物叫做碱如:KOH==K++OH-
NaOH==Na++OH-
Ba(OH)2==Ba2++2OH-
27、盐:由金属和酸根组成的化合物叫做盐。如:KNO3==K++NO3-
Na2SO4==2Na++SO42-
BaCl2==Ba2++2Cl-
28、PH=7溶液呈中性,PH值越接近0,酸性越强;PH值越接近14,碱性越强;PH值越接近7,溶液的酸、碱性就越弱,越接近中性。
29、金属活动性顺序表:(钾、钙、钠、镁、铝、锌、铁、锡、铅、氢、铜、汞、银、铂、金)
说明:(1)越左金属活动性就越强,左边的金属可以从右边金属的盐溶液中置换出该金属出来(2)排在氢左边的金属,可以从酸中置换出氢气;排在氢右边的则不能。(3)钾、钙、钠三种金属比较活泼,它们直接跟溶液中的水发生反应置换出氢气
30、比较(探究)金属活动性的方法:
1、将金属跟稀盐酸(稀硫酸)反应
2、将金属跟盐反应,能置换则比其强,不能置换则比其弱。
如比较Zn、Fe、Cu的活动性可以用一下3种方法:
(1)将Zn、Fe、Cu分别伸到稀硫酸中:
(2)将Fe分别伸到ZnSO4和CuSO4溶液中(中间金属两边盐)
(3)将Zn、Cu伸到FeSO4溶液中(两边金属中间盐)
31、化学肥料:氮、磷、钾,叶、根、茎,氮、磷、钾两种以上元素复合肥。
32、元素周期表的规律:族(纵行)最外层电子数相等,化学性质相似,从上到下电子层数依次增加1;周期(横行)电子层数相等,从左到右最外层电子数依次增加1。
二、物质的结构
1、化学符号的意义及书写:
(1)化学符号的意义:a.元素符号:①表示一种元素;②表示该元素的一个原子。b.离子符号:表示离子及离子所带的电荷数。c.化合价符号:表示元素或原子团的化合价。当符号前面有数字(化合价符号没有数字)时,此时组成符号的意义只表示该种粒子的个数。
(2)化学符号的书写:
a.原子的表示方法:用元素符号表示b.分子的表示方法:用化学式表示。H2、O2、N2、F2、Cl2、Br2、I2c.离子的表示方法:用离子符号表示。Al3+、Fe3+、Fe2+、Cl-、NO3-、SO42-、NH3+d.化合价的表示方法:用化合价符号表示
2、化学符号周围数字的含义:正前方粒子数,正上方化合价,右上角(每个离子)电荷,右下角(每个分子)原子数。
化合价口诀:
氟氯溴碘负一价,正一氢银和钠钾;
氧二硅四价铁二三,二四六硫二四碳;
三五氮磷四七锰, 正二钡钙镁锌铜;
铝三一正一铜汞, 一五七氯单质零;
一价硝酸氢氧根,二价碳酸硫酸根;
三价磷酸根。
注:原子、分子、离子三种粒子个数不只“1”时,只能在符号的前面加,不能在其它地方加。
三、制取气体常用的发生装置和收集装置
1、三种气体的实验室制法以及它们的区别:
?氧气(O2)
药品:高锰酸钾(KMnO4)氯酸钾(KClO3)或双氧水(H2O2)和二氧化锰
(MnO2)2KMnO4==K2MnO4+MnO2+O2↑
2KClO3 MnO2 2KCl + 3O2 ↑[固+固)]
或2H2O2====2H2O+O2↑[固+液]
②氢气(H2)
药品:锌粒(Zn)和盐酸(HCl)或稀硫酸(H2SO4)
Zn+H2SO4=ZnSO4+H2↑[固+液]
Zn+2HCl=ZnCl2+H2↑[固+液]
③二氧化碳(CO2)
药品:石灰石(大理石)(CaCO3)和稀盐酸(HCl)
CaCO3+2HCl=CaCl2+H2O+CO2↑[固+液]
2、三种气体的检验
检验氧气:用带火星的木条,伸进集气瓶,若木条复燃,是氧气;否则不是氧气。
检验氢气:点燃木条,伸入瓶内,木条上的火焰熄灭,瓶口火焰呈淡蓝色,则该气体是氢气。
检验CO2气:通入澄清的石灰水,看是否变浑浊,若浑浊则是CO2。
3、两种气体的验满
氧气验满:用带火星的木条,平放在集气瓶口,若木条复燃,氧气已满,否则没满。
CO2气验满:用带燃着的木条,平放在集气瓶口,若木条熄灭, CO2气已满,否则没满。
四、常见物质的特性
1、常见物质的颜色:多数气体为无色,多数固体化合物为白色,多数溶液为无色。
2、一些特殊物质的颜色:
黑色:MnO2、CuO、Fe3O4、C、
蓝色:Cu(OH)2、CuCO3、含Cu2+溶液、液态固态O2(淡蓝色)
红色:Cu(亮红色)、Fe2O3(红棕色)、红磷(暗红色)
黄色:硫磺(单质S)、含Fe3+的溶液(棕黄色)
绿色:含Fe2+的溶液(浅绿色)、碱式碳酸铜[Cu2(OH)2CO3]
无色气体:N2、CO2、CO、O2、H2、CH4
有色气体:Cl2(黄绿色)、NO2(红棕色)
有刺激性气味的气体:NH3(此气体可使湿润pH试纸变蓝色)、SO2
有臭鸡蛋气味:H2S3
常见一些变化的判断:
①蓝色沉淀:Cu(OH)2
②红褐色沉淀:Fe(OH)3
③白色沉淀且不溶于稀硝酸或酸的物质有:BaSO4、AgCl(就这两种物质)
④沉淀能溶于酸并且有气体(CO2)放出的:CaCO3、BaCO3
⑤沉淀能溶于酸但没气体放出的:Mg(OH)2
五、初中化学有关计算公式
计算题的类型有:
①有关质量分数(元素和溶质)的计算
②根据化学方程式进行计算
③由①和②两种类型混合在一起计算
1、相对分子质量=(相对原子质量×原子个数)之和
2、组成元素的质量比=(相对原子质量×原子个数)之比
3、化合物中某元素的质量分数等于

4、某元素的质量=某化合物的质量×某元素质量分数

5、有关纯度的计算

6、溶液中溶质质量分数的计算
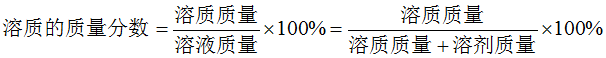
7、饱和溶液中溶质的质量分数的计算公式:

8、有关溶液的稀释计算:(依据:稀释前后溶液中的溶质的质量不变。)
加水稀释:M浓 × a%浓=M稀 × b%稀
M浓 × a%浓=(M浓+增加的溶剂质量设其为X) × b%稀
(五)、解题技巧
1、审题:看清题目的要求,已知什么,求什么,有化学方程式的先写出化学方程式。找出解此题的有关公式。找出一个纯物质的质量代入列比利式进行计算。
找纯物质的质量的方法:
①用公式间接求纯物质质量;②气体(质量) ;③沉淀( 质量);④直接给出参与反应的纯物质质量。⑤应用质量守恒定律找。
求溶质的方法:①放在化学方程式中求;②用溶质质量分数公式求(溶质质量=溶液质量×溶质质量分数)
2、根据化学方程式计算的解题步骤:
①设未知量
②书写出正确的化学方程式
③写出有关物质的相对分子质量、已知量、未知量
④列出比例式,求解
⑤答。
六,常见物质的化学名称、俗名和化学式
汞(水银)Hg 硫(硫磺)S 氧化钙(生石灰)CaO
固体二氧化碳(干冰)CO2 氧化铁(铁锈的主要成分)Fe2O3
碳酸钙(大理石、石灰石的主要成分)CaCO3
氯化钠(食盐)NaCl 甲烷(沼气、天然气)CH4
乙醇(酒精)C2H5OH 乙酸(醋酸)CH3COOH
碳酸钠(纯碱)Na2 CO3 氢氧化钠(烧碱、火碱、苛性钠)NaOH
氢氧化钙(熟石灰、消石灰)Ca(OH)2水煤气:氢气和一氧化碳的混合物 爆鸣气:氢气和氧气的混合物
七,物质的分类规律
一种物质纯净物:多种物质混合物:一种元素是单质:多种元素化合物
含碳元素有机物:不含碳是无机物:左另右氧氧化物:左氢右酸根是酸:
左金属右氢氧碱:左金属右酸根盐:
八,初中化学实验中的先后
1.稀释浓硫酸时,往烧杯里先加水,后加浓硫酸.
2.实验室制取氧气:开始时,先给试管加热,后把导管口伸入盛满水的集气瓶内;结束时,先把导管移出水面,后熄灭酒精灯.
3.制取气体时,先检查装置的气密性,后装药品.
4.用固体药品和液体药品反应制取气体先加固体,后加液体。
5. 点燃或加热H2、CO、CH4等可燃性气体时,先检验H2、CO、CH4等气体的纯度,后点燃或加热H2、CO、CH4等可燃性气体。
6. KMnO4受热分解制取O2,用排水法收集O2,实验结束时,先将导管移出水面,后熄灭酒精灯。
7. 酸碱中和滴定反应中,先在氢氧化钠溶液中滴加1-2滴酚酞试液,后用胶头滴管滴加稀盐酸至溶液刚刚褪为无色为止。
九,初中化学方程式总结
(一)、化合反应
1、铁在氧气中燃烧:
3Fe + 2O2 点燃 Fe3O4
2、氢气中空气中燃烧:
2H2 + O2 点燃 2H2O
3、红(白)磷在空气中燃烧:
4P + 5O2 点燃 2P2O5
4、碳在氧气中不充分燃烧:
2C + O2 点燃 2CO
5、二氧化碳通过灼热碳层:
C + CO2 高温 2CO(是吸热的反应)
6、一氧化碳在氧气中燃烧:
2CO + O2 点燃 2CO2
7、二氧化碳和水反应(二氧化碳通入紫色石蕊试液):
CO2 + H2O === H2CO3
(二)、分解反应:
8、水在直流电的作用下分解:
2H2O 通电 2H2↑+ O2 ↑
9、加热氯酸钾(有少量的二氧化锰):
2KClO3 MnO2 2KCl + 3O2 ↑
10、加热高锰酸钾:
2KMnO4 △K2MnO4 + MnO2 + O2↑
11、实验室用双氧水制氧气:
2H2O2 MnO2 2H2O+ O2↑
12、锻烧石灰石:
CaCO3 CaO+CO2↑
CaO+CO2↑
13、碳酸不稳定而分解:
H2CO3 === H2O + CO2↑
(三)、置换反应:
14、锌和稀硫酸反应:
Zn + H2SO4 === ZnSO4 + H2↑
15、铝和稀硫酸反应:
2Al + 3H2SO4 === Al2(SO4)3 + 3H2↑
16、锌和稀盐酸反应:
Zn + 2HCl === ZnCl2 + H2↑
17、铝和稀盐酸反应:
2Al + 6HCl === 2AlCl3 + 3H2↑
18、铁与硫酸铜反应:
Fe+CuSO4==Cu+FeSO4
19、铜片放入硝酸银溶液中:
2AgNO3+Cu==Cu(NO3)2+2Ag
20、铜和硝酸汞溶液反应:
Cu+Hg(NO3)2===Cu(NO3)2+Hg
21、焦炭还原氧化铁:
3C+ 2Fe2O3 高温 4Fe + 3CO2↑
22、木炭还原氧化铜:
C+ 2CuO 高温 2Cu + CO2↑
(四)、复分解反应:
23.氧化铁和稀盐酸反应:
Fe2O3+6HCl===2FeCl3+3H2O
24.氧化铁和稀硫酸反应:
Fe2O3+3H2SO4===Fe2(SO4)3+3H2O
25.苛性钠暴露在空气中变质:
2NaOH+CO2====Na2CO3+H2O
26.二氧化碳通入澄清石灰水:
CO2 +Ca(OH)2 ==CaCO3↓+ H2O
27. 氢氧化铝药物治疗胃酸过多:
3HCl+Al(OH)3====AlCl3+3H2O
28.大理石与稀盐酸反应:
CaCO3+2HCl===CaCl2+H2O+CO2↑
29.碳酸钠与稀盐酸反应:
Na2CO3+2HCl===2NaCl+H2O+CO2↑
30.盐酸和硝酸银溶液反应:
HCl+AgNO3===AgCl↓+HNO3
31. 硫酸和氯化钡溶液反应:
H2SO4+BaCl2====BaSO4↓+2HCl
32.氢氧化钠与硫酸铜:
2NaOH+CuSO4====Cu(OH)2↓+Na2SO4
33.氢氧化钠与氯化铁:
3NaOH+FeCl3====Fe(OH)3↓+3NaCl
34. 氢氧化钠与氯化铜:
2NaOH+CuCl2====Cu(OH)2↓+2NaCl
35. 氢氧化钙与碳酸钠:
Ca(OH)2+Na2CO3===CaCO3↓+2NaOH
36. 氢氧化钙与硫酸:
Ca(OH)2+H2SO4==CaSO4+2H2O
37.氯化钠溶液和硝酸银溶液:
NaCl+AgNO3====AgCl↓+NaNO3
38.硫酸钠和氯化钡:
Na2SO4+BaCl2====BaSO4↓+2NaCl
(五)、其它反应(不属于基本反应类型)
39、甲烷在空气中燃烧:
CH4 + 2O2 点燃 CO2 + 2H2O
40、酒精在空气中燃烧:
C2H5OH + 3O2 点燃 2CO2 + 3H2O
41、一氧化碳还原氧化铜:
CO+ CuO 加热 Cu + CO2
42、一氧化碳还原氧化铁:
Fe2O3+3CO  2Fe + 3CO2
2Fe + 3CO2
43、一氧化碳还原四氧化三铁:
Fe3O4+4CO 3Fe+4CO2
3Fe+4CO2
温馨提示:因格式问题,文中上下角标可能未正确显示,请您书写时注意正确书写,切记因此丢分。